
AR抑制劑不能增強(qiáng)PARP抑制劑對HR正常前列腺癌的療效,反而通過阻滯細(xì)胞周期削弱其作用。DNA修復(fù)不受AR直接調(diào)控,協(xié)同作用缺乏理論支持。成果發(fā)表在PNAS雜志(IF:9.1);

《Proceedings of the National Academy of Sciences of the United States of America》簡稱PNAS,創(chuàng)刊于1915年,是美國國家科學(xué)院的guan方學(xué)術(shù)期刊,是shi界gong認(rèn)的*綜合性科學(xué)周刊之一。它致力于發(fā)表具有杰出原創(chuàng)性、重要科學(xué)貢獻(xiàn)和廣泛跨學(xué)科影響的前沿研究。發(fā)表涵蓋生物科學(xué)、物理科學(xué)、社會科學(xué)、數(shù)學(xué)和工程學(xué)等幾乎所有自然科學(xué)與社會科學(xué)分支的研究。年文章數(shù)約3000篇;提供混合開放獲取模式。
當(dāng)前,針對同源重組修復(fù)功能正常的去勢抵抗性前列腺癌,臨床前研究曾提出雄激素受體(AR)通路抑制劑與聚腺苷二磷酸核糖聚合酶(PARP)抑制劑聯(lián)合治療的協(xié)同作用假說。該假說基于AR可調(diào)控DNA損傷修復(fù)基因(如BRCA1/2)表達(dá)的理論,認(rèn)為抑制AR通路可誘導(dǎo)“BRCAness"表型,從而增強(qiáng)腫瘤對PARP抑制劑的敏感性。然而,多項臨床研究顯示,該聯(lián)合方案在HR正常患者中僅帶來有限的生存獲益,且美國食品藥品監(jiān)督管理局未批準(zhǔn)其用于HR正常人群,凸顯了現(xiàn)有理論與臨床結(jié)果之間的顯著矛盾。這一爭議促使研究人員重新審視AR與DNA修復(fù)之間的調(diào)控關(guān)系,并深入探究在HR正常前列腺癌模型中AR抑制劑與PARP抑制劑相互作用的真實(shí)機(jī)制。
研究方法:
研究采用多種同源重組修復(fù)功能正常(HR-proficient)的前列腺癌細(xì)胞系(包括去勢敏感型LNCaP和去勢抵抗型22RV1、LNCaP-abl等)以及HR缺陷型對照細(xì)胞(BRCA2缺失的LuCaP176細(xì)胞),系統(tǒng)評估了雄激素受體靶向療法與PARP抑制劑的相互作用。在方法學(xué)上,研究通過細(xì)胞活力檢測(Cell Titer Glo)評估藥物單用及聯(lián)用的效果;利用γH2AX和RAD51免疫熒光染色定量分析DNA損傷與修復(fù)狀態(tài);采用RNA測序和ATAC測序分別在轉(zhuǎn)錄組和染色質(zhì)可及性層面解析藥物處理的分子變化;并通過免疫印跡驗(yàn)證關(guān)鍵蛋白表達(dá)。為驗(yàn)證細(xì)胞周期的作用,研究使用了CDK4/6抑制劑帕博西尼(palbociclib)和CDK7抑制劑SY-1365進(jìn)行功能干預(yù)。此外,研究還結(jié)合了公共臨床轉(zhuǎn)錄組數(shù)據(jù),分析雄激素剝奪治療(ADT)前后患者腫瘤中細(xì)胞周期相關(guān)通路的變化,從而在臨床樣本層面佐證機(jī)制發(fā)現(xiàn)。整體實(shí)驗(yàn)設(shè)計涵蓋了從體外模型到臨床關(guān)聯(lián)的多層次驗(yàn)證,系統(tǒng)闡明了藥物響應(yīng)機(jī)制。
1. AR抑制在前列腺癌去勢敏感或去勢抵抗模型中均不與PARP抑制產(chǎn)生協(xié)同作用
在雄激素剝奪或使用恩雜魯胺抑制AR信號后,去勢敏感型前列腺癌細(xì)胞(LNCaP)對多種PARP抑制劑(包括奧拉帕利、盧卡帕利、他拉唑帕利及AZD-5305)的敏感性顯著下降,表現(xiàn)為IC50值上升。然而,在去勢抵抗型前列腺癌細(xì)胞系(22RV1、LN95、LNCaP-abl)中,AR抑制并未改變其對PARP抑制劑的敏感性。即使在臨床相關(guān)濃度下(10 μM恩雜魯胺與1 μM PARPi),聯(lián)合用藥也未能比單一用藥顯示出額外的細(xì)胞生長抑制優(yōu)勢。這些結(jié)果證明,AR抑制不僅無法與PARP抑制劑在HR正常的癌細(xì)胞中產(chǎn)生協(xié)同作用,反而在去勢敏感模型中會削弱PARP抑制劑的療效。

圖1,AR抑制不改變?nèi)莸挚剐郧傲邢侔?/span>PARP抑制的敏感性
2. PARP抑制劑治療可調(diào)控AR相關(guān)基因的表達(dá)
隨后,研究人員通過轉(zhuǎn)錄組分析揭示了PARP抑制劑在有無AR抑制條件下對HR正常前列腺癌細(xì)胞基因表達(dá)的影響。結(jié)果顯示,PARP抑制劑處理顯著誘導(dǎo)了CYP家族基因(如CYP1A、CYP1B)的表達(dá)。通路富集分析表明,在雄激素(DHT)存在的條件下,PARP抑制劑激活了p53通路并誘導(dǎo)細(xì)胞凋亡,同時抑制了細(xì)胞周期相關(guān)通路(如E2F靶標(biāo)、G2/M檢查點(diǎn));而在雄激素剝奪條件下,這些細(xì)胞周期和凋亡通路的改變顯著減弱甚至消失。這一發(fā)現(xiàn)與圖1中觀察到的生長抑制結(jié)果一致,表明PARP抑制劑的抗癌效果依賴于雄激素存在下的細(xì)胞周期進(jìn)程,而非通過AR直接調(diào)控的DNA修復(fù)通路。

圖2,PARP抑制誘導(dǎo)細(xì)胞周期和DNA損傷應(yīng)答通路的變化
進(jìn)一步的研究結(jié)果揭示了PARP抑制劑對AR驅(qū)動轉(zhuǎn)錄的調(diào)控作用及機(jī)制。RNA-seq分析顯示,在DHT刺激的22RV1細(xì)胞中,PARP抑制劑能夠抑制一部分雄激素響應(yīng)基因的誘導(dǎo)表達(dá)(Cluster 2與Cluster 4),這些基因富集于細(xì)胞周期與代謝通路;而在LNCaP細(xì)胞中,PARP抑制劑僅對少量AR調(diào)控基因有抑制作用。ATAC-seq分析進(jìn)一步發(fā)現(xiàn),PARP抑制劑(如奧拉帕利)在DHT存在時會導(dǎo)致一部分染色質(zhì)區(qū)域的可及性降低,但這種變化與基因表達(dá)改變的重合度很低。例如,LRRC4基因的可及性雖受DHT調(diào)控,卻不受奧拉帕利影響。這些結(jié)果綜合表明,PARP抑制劑對AR調(diào)控基因表達(dá)的影響主要在轉(zhuǎn)錄水平發(fā)生,而非通過改變?nèi)旧|(zhì)可及性來實(shí)現(xiàn)。

圖3,PARP抑制劑對AR驅(qū)動轉(zhuǎn)錄的調(diào)控作用及機(jī)制
3. 雄激素剝奪或AR抑制不會抑制DNA修復(fù)。
RNA-seq分析顯示,無論是在雄激素剝奪還是DHT處理的條件下,DNA修復(fù)相關(guān)基因(包括先前報道的AR靶基因如BRCA2)的表達(dá)均未受到顯著抑制。ATAC-seq數(shù)據(jù)進(jìn)一步證實(shí),AR抑制并未改變BRCA1/BRCA2等關(guān)鍵修復(fù)基因位點(diǎn)的染色質(zhì)可及性。功能實(shí)驗(yàn)通過γH2AX焦點(diǎn)形成檢測發(fā)現(xiàn),在去勢敏感LNCaP細(xì)胞中,雄激素剝奪反而減弱了PARP抑制劑(奧拉帕利)誘導(dǎo)的DNA損傷;而在去勢抵抗22RV1細(xì)胞中,DNA損傷水平不受雄激素狀態(tài)影響。這些證據(jù)一致表明,AR通路抑制并不直接削弱前列腺癌細(xì)胞的DNA修復(fù)能力,也無法增強(qiáng)PARP抑制劑所致的DNA損傷。

圖4,AR不直接調(diào)控DNA修復(fù)基因的表達(dá)
4. 細(xì)胞周期進(jìn)展是響應(yīng)PARP抑制的必要條件
研究發(fā)現(xiàn),在去勢敏感LNCaP細(xì)胞中,高劑量DHT(10 nM)誘導(dǎo)的細(xì)胞生長抑制會嚴(yán)重削弱奧拉帕利的療效,其效果甚至強(qiáng)于雄激素剝奪。為驗(yàn)證這一現(xiàn)象是否存在于患者體內(nèi),研究人員分析了公共臨床測序數(shù)據(jù),發(fā)現(xiàn)雄激素剝奪治療(ADT)顯著抑制了患者腫瘤中細(xì)胞周期相關(guān)通路(E2F靶點(diǎn)、G2/M檢查點(diǎn))的基因表達(dá),確認(rèn)ADT在臨床上確實(shí)會引起細(xì)胞周期停滯。為直接驗(yàn)證細(xì)胞周期的作用,研究使用CDK4/6抑制劑帕博西尼(Palbociclib)誘導(dǎo)G1期阻滯,發(fā)現(xiàn)這顯著降低了多種PARP抑制劑(奧拉帕利、盧卡帕利、他拉唑帕利、AZD-5305)在HR正常前列腺癌細(xì)胞中的療效。這種效應(yīng)并不僅限于PARP抑制劑,同樣也削弱了傳統(tǒng)DNA損傷化療藥物(如順鉑、依托泊苷、多柔比星)的作用,表明細(xì)胞周期依賴性是DNA損傷類藥物的普遍機(jī)制。有趣的是,在HR缺陷(BRCA2缺失)的LuCaP176細(xì)胞模型中,使用CDK7抑制劑SY-1365抑制細(xì)胞增殖,并未削弱奧拉帕利的療效。這揭示了一個關(guān)鍵差異:細(xì)胞周期進(jìn)展僅是HR正常細(xì)胞響應(yīng)PARP抑制的必要條件,而在HR缺陷細(xì)胞中并非必需。
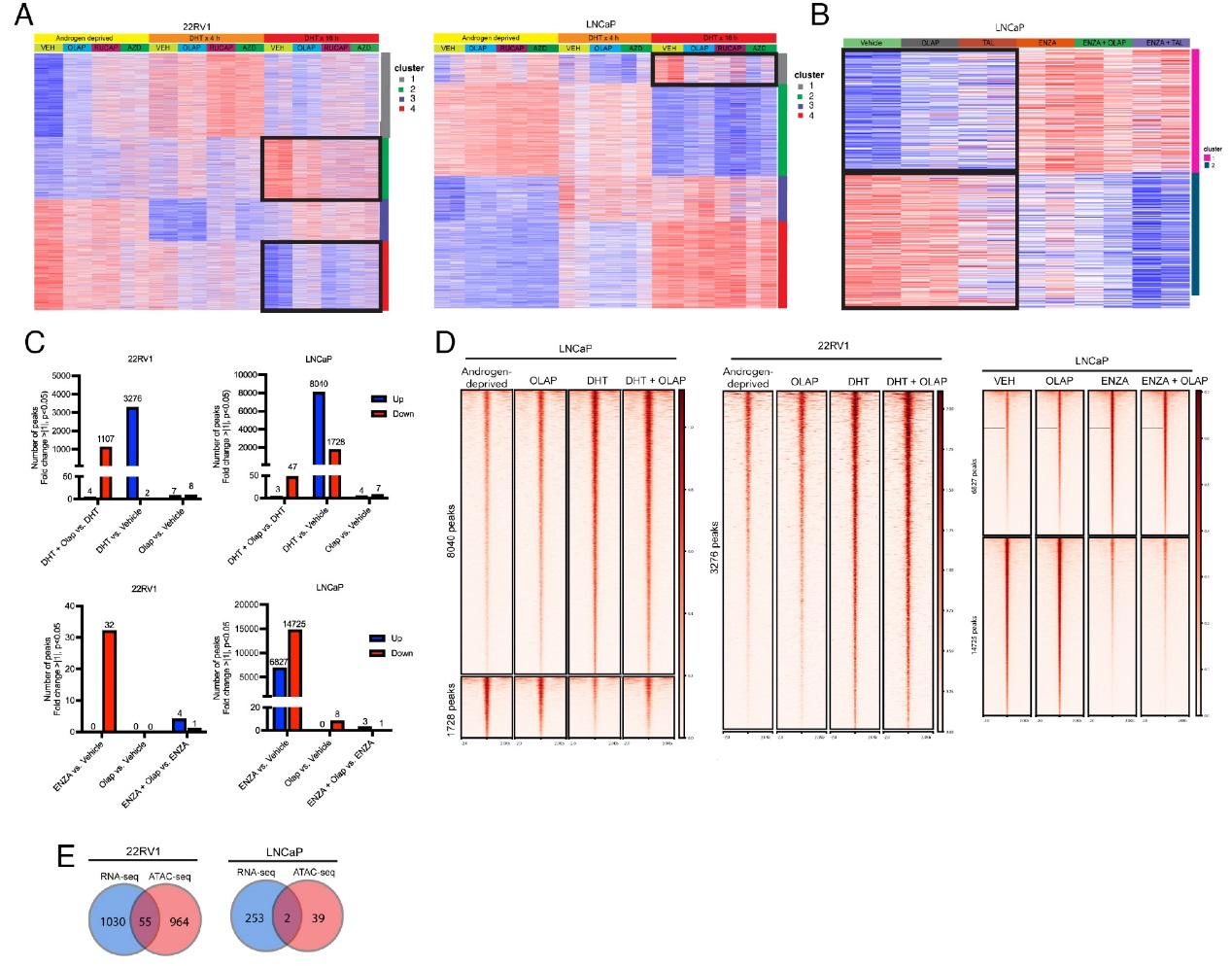
圖5,抑制細(xì)胞周期進(jìn)展會削弱對PARP抑制劑的治療反應(yīng)。
5. 全文總結(jié)
本研究dian覆了“AR抑制劑通過抑制DNA修復(fù)來協(xié)同PARP抑制劑"的傳統(tǒng)理論,shou次揭示在HR正常前列腺癌中,細(xì)胞周期進(jìn)展才是PARP抑制劑起效的關(guān)鍵前提。AR抑制劑會誘導(dǎo)G1期阻滯,從而削弱PARP抑制劑的療效,這解釋了二者聯(lián)合療法在HR正常患者中效果不佳的原因。該發(fā)現(xiàn)提示臨床應(yīng)避免對HR正常患者聯(lián)合使用PARP抑制劑與細(xì)胞周期阻滯類藥物(如ADT),同時支持繼續(xù)探索該聯(lián)合方案在HR缺陷患者中的應(yīng)用。盡管研究主要基于細(xì)胞模型且深層機(jī)制有待闡明,但其結(jié)論為前列腺癌精準(zhǔn)治療提供了重要的理論轉(zhuǎn)向與臨床指導(dǎo)依據(jù)。
歡迎您關(guān)注我們的微信公眾號了解更多信息
 掃一掃
掃一掃